研究ファイルNo.96:日本人の飲酒行動を決定づける遺伝的構造
飲酒は様々な疾患や障害に関連します。アルコールの代謝に関わる酵素ALDH2の遺伝子(ALDH2)には、日本人の飲酒行動に最も強力な影響を与える遺伝的要因となる、重要な遺伝的な違い(バリアント)が存在します。その重要なバリアントは、ALDH2遺伝子上の特定の場所にある1つの塩基がGからAに変化する一塩基多型(SNP)で、「rs671」と呼ばれています。rs671により、日本人は、GG型、GA型、AA型という3つの遺伝型に分けられ、どの遺伝型を持つかによって飲酒行動に明確な違いがあります。GG型の場合、アセトアルデヒドを代謝できるため飲酒後のフラッシング反応が起こりにくく、飲酒する傾向にあります。欧米系集団ではほとんどがこの GG型です。一方、AA型はアセトアルデヒドの分解能力が極めて低くほぼ飲酒しません。中間のGA型はGG型よりアセトアルデヒドの分解能力が低いものの、人によって幅広い飲酒パターンを示します。
この遺伝型による飲酒行動の違いは、頭頸部がんや食道がんなどの飲酒関連がんのリスクにも大きく寄与します。飲酒してもアセトアルデヒドが蓄積しにくいGG型と飲酒をしないAA型は飲酒関連がんのリスクが低いのに対し、GA型は飲酒によるアセトアルデヒド曝露量の上昇に伴い飲酒関連がんの最も高いリスクを有します。このため、GA型の幅広い飲酒行動を決定する別の遺伝的要因の同定は、飲酒関連がんの個別化予防に寄与すると考えられます。
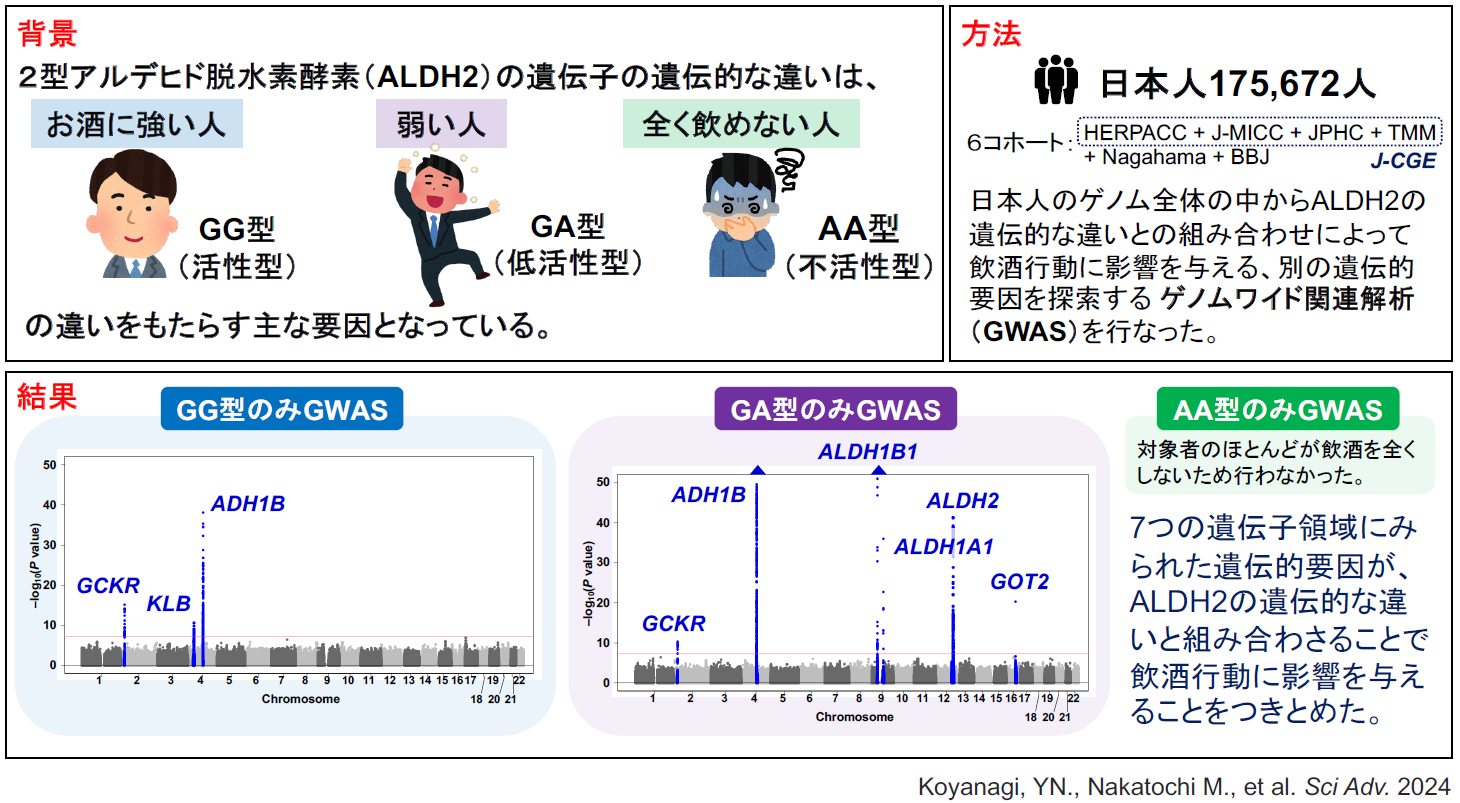
本研究はまず、愛知県がんセンター病院疫学研究(HERPACC)、日本多施設共同コーホート研究(J-MICC Study)、多目的コホート研究(JPHC Study)及び東北メディカル・メガバンク計画(TMM)の4つの分子疫学研究を含む日本分子疫学コンソーシアム(J-CGE)、ながはまコホート(Nagahama)及びバイオバンク・ジャパン(BBJ)より収集された日本人集団175,672人の遺伝情報と飲酒行動の情報を用いて、日本人のゲノム全体の中からALDH2 rs671の遺伝型にかかわらず飲酒行動に関連するバリアントを探すゲノムワイド関連解析(GWAS)を行いました(「層別なし解析」)。その結果、ALDH2を含む6つの遺伝子領域(GCKR遺伝子、KLB遺伝子、ADH1B遺伝子、ALDH1B1遺伝子、ALDH1A1遺伝子、ALDH2遺伝子)上のSNPが飲酒関連バリアントとして同定されました。(図1)
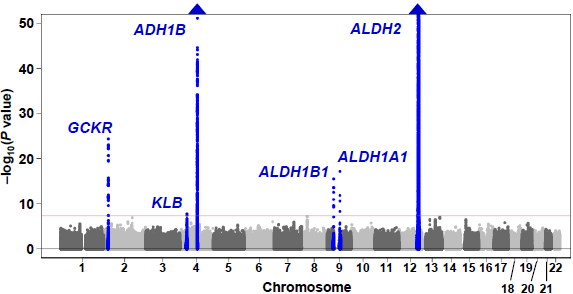
図1.1日アルコール摂取量のGWASのマンハッタンプロット(層別なし解析)
次に、それぞれのrs671遺伝型別にGWASを行いました(「層別あり解析」)。AA型は対象者のほとんどが飲酒を全くしないためAA型のみのGWASは行いませんでした。層別あり解析の結果、GG型では3つの遺伝子領域(GCKR遺伝子、KLB遺伝子、ADH1B遺伝子)上のSNPが飲酒関連バリアントとして同定されましたが(図2A)、これらはrs671遺伝型がほとんどGG型である欧米系集団を対象とした飲酒行動GWASでよく検出される遺伝子領域と一致しました。一方で、GA型ではアルコール代謝関連遺伝子であるADH1B、ALDH1B1、ALDH1A1、ALDH2遺伝子を含む6つの遺伝子領域(GCKR遺伝子、ADH1B遺伝子、ALDH1B1遺伝子、ALDH1A1遺伝子、ALDH2遺伝子、GOT2遺伝子)上のSNPが飲酒関連バリアントとして同定されました。(図2 B)
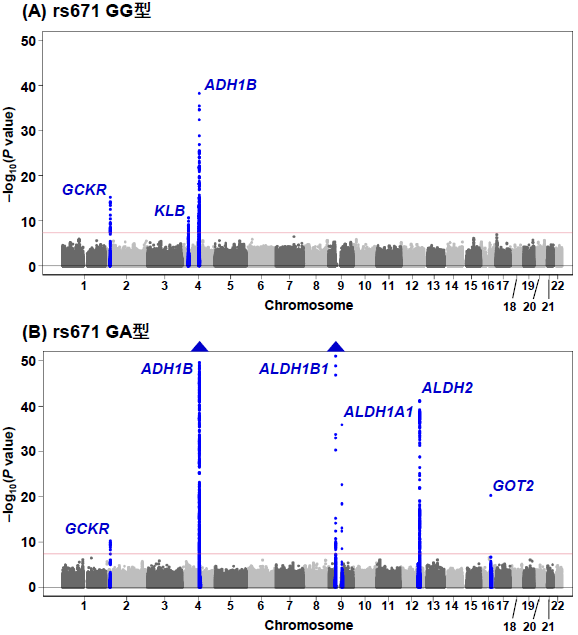
図2.1日アルコール摂取量のGWASのマンハッタンプロット(層別あり解析)
図3は、層別あり解析により同定された遺伝子領域で最も関連の高いSNPの飲酒への効果の大きさを示しています。各SNPの飲酒への効果の大きさは、rs671遺伝型の違いにより大きく異なっていました。例えば、ALDH1A1 rs8187929はALDH1A1遺伝子上の1つの塩基がTからAのバリアントに変化するSNPですが、rs671 GG型の人がALDH1A1 rs8187929にA塩基(TA型やAA型)を持っていても飲酒量は変わらないのに対し、rs671 GA型の人がALDH1A1 rs8187929に A塩基を持つと飲酒量が増えます。このようにrs671遺伝型で層別化したGWASを行うことで、遺伝型によって表現型(今回の場合は飲酒量)への影響が異なるSNPが明らかになり、SNPが単独ではなく複数組み合わさって表現型に影響している(「交互作用」といいます)ことが示されました。
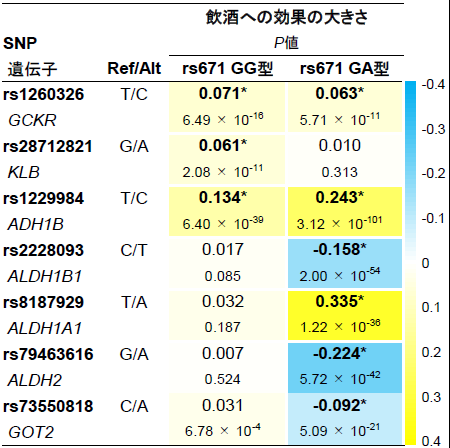
図3.層別あり解析で同定されたSNPの飲酒量への効果量
さらに、層別あり解析で同定された7つのSNPと代表的な飲酒関連疾患である食道がんリスクとの関連を検討するため、HERPACCとBBJにより収集された食道がん症例群と非がん対照群を用いた食道がん症例対照研究を行いました。その結果、本研究で同定されたSNPの中には、ALDH2の遺伝的な違いとの組み合わせにより食道がんのリスクをより高めるものが存在することがわかりました。また、層別あり解析で同定された7つのSNPのうち4つ(GCKR、ADH1B、ALDH1A1、ALDH2)が食道がんリスクに対してもrs671と「交互作用」を伴って関連していることが示唆されました(P値 < 0.05)。 今回の研究結果から、飲酒行動の遺伝的背景には、rs671と複数のSNPが「交互作用」を伴い関与していることが示されました。このように、「遺伝型層別GWAS」を用いた研究アプローチは、表現型に対して強力な影響を持つSNPがある場合、このSNPと交互作用を発揮する新規SNPを検出するための有効な手法であると考えられます。層別あり解析で同定されたSNPには、飲酒行動だけでなく食道がんリスクにもrs671と「交互作用」を伴い関与するものが存在しており、日本人の遺伝的背景に基づく飲酒関連がんの個別化予防のさらなる促進に寄与することが期待されます。
出典:
- Koyanagi YN†*, Nakatochi M†*, Namba S, Oze I, Charvat H, Narita A, Kawaguchi T, Ikezaki H, Hishida A, Hara M, Takezaki T, Koyama T, Nakamura Y, Suzuki S, Katsuura-Kamano S, Kuriki K, Nakamura Y, Takeuchi K, Hozawa A, Kinoshita K, Sutoh Y, Tanno K, Shimizu A, Ito H, Kasugai Y, Kawakatsu Y, Taniyama Y, Tajika M, Shimizu Y, Suzuki E, Hosono Y, Imoto I, Tabara Y, Takahashi M, Setoh K; BioBank Japan Project; Matsuda K, Nakano S, Goto A, Katagiri R, Yamaji T, Sawada N, Tsugane S, Wakai K, Yamamoto M, Sasaki M, Matsuda F, Okada Y, Iwasaki M, Brennan P, Matsuo K*.
Genetic architecture of alcohol consumption identified by a genotype-stratified GWAS and impact on esophageal cancer risk in Japanese people Sci Adv. 2024; 10(4):eade2780.
(†:第一著者、*:責任著者)